新闻资讯
分光光度计是蛋白质定量与定性分析的核心仪器,其原理是基于朗伯-比尔定律,通过检测蛋白质溶液对特定波长光的吸收或散射程度,实现对蛋白质浓度、结构及相互作用的分析。

便携式分光光度计
蛋白质浓度的定量分析
这是分光光度计最基础且高频的应用,主要分为直接检测法和显色剂结合法两类。
紫外吸收直接检测法(280nm法)
- 原理:蛋白质分子中的酪氨酸(Tyr)、色氨酸(Trp)等芳香族氨基酸残基,在280nm紫外光下有特征性强吸收;此外,肽键在205nm处也有紫外吸收(适用于低浓度或不含芳香族氨基酸的蛋白质)。
- 优势:无需添加显色剂、不破坏蛋白质结构、操作快速,可直接测定天然蛋白溶液浓度,适合纯化过程中的实时监测。
- 局限性:易受核酸、游离氨基酸等杂质干扰;不同蛋白质的芳香族氨基酸含量差异大,需结合标准蛋白校准。
显色剂结合比色法
通过显色剂与蛋白质的特异性结合,生成有色复合物,在可见光区检测吸光度,灵敏度高于紫外直接法,常见方法包括:
- 考马斯亮蓝法(Bradford法)
原理:考马斯亮蓝G-250在酸性条件下与蛋白质的疏水区结合,颜色从棕红色变为蓝色,在595nm处有最大吸收峰。
特点:灵敏度高(检测下限达μg级)、操作简便,但易受去污剂干扰,适合常规蛋白定量。
- 双缩脲法
原理:蛋白质中的肽键在碱性条件下与 Cu2+结合生成紫色络合物,在540nm处检测吸光度。
特点:结果稳定、受蛋白质种类影响小,但灵敏度较低,适合高浓度蛋白(mg级)测定。
- Lowry法
原理:结合双缩脲反应和福林酚试剂的还原反应,生成蓝色复合物,在750nm处检测,灵敏度介于Bradford法和双缩脲法之间,但易受酚类、糖类杂质干扰。
蛋白质结构与构象分析
蛋白质的结构(二级、三级)变化会导致其紫外吸收光谱、荧光光谱的特征峰位移,分光光度计可通过光谱扫描实现构象分析:
紫外差示光谱法
当蛋白质构象改变时,芳香族氨基酸残基的微环境发生变化,其280nm附近的吸收峰强度或波长会偏移。通过对比天然态与变性态蛋白的紫外吸收光谱差值,可判断构象变化程度。
圆二色光谱法(CD 光谱)
利用圆二色分光光度计检测蛋白质对左旋和右旋圆偏振光的吸收差异,是分析蛋白质二级结构的金标准:
- α-螺旋:在192nm处有正峰,208nm、222nm处有负峰;
- β-折叠:在195nm处有正峰,218nm处有负峰;
- 无规卷曲:无特征峰。
通过拟合 CD 光谱数据,可定量计算蛋白质中α-螺旋、β-折叠、无规卷曲的比例。
蛋白质纯度与杂质检测
纯度鉴定
纯蛋白质的紫外吸收光谱具有特征性的峰形和比值,常用A280/A260比值判断纯度:
- 纯蛋白的A280/A260≈1.8;
- 若比值偏低,提示存在核酸杂质(核酸在260nm处有强吸收);若比值偏高,可能存在酚类、色素等杂质。
杂质定量
例如检测蛋白质溶液中的核酸杂质:通过测定A260和A280,结合公式计算核酸的相对含量。
蛋白质的动力学与相互作用分析
酶促反应动力学
分光光度计可实时监测酶促反应过程中底物或产物的吸光度变化,计算酶的米氏常数(Km)、最大反应速率(Vmax)等参数。
蛋白质-配体相互作用
当蛋白质与小分子配体结合时,其紫外或荧光光谱会发生变化,通过监测吸光度变化可计算结合常数(Ka)、结合位点数量等参数,用于药物筛选、配体结合机制研究。
特殊应用:蛋白质电泳后的定量分析
聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质后,可将凝胶条带切下,经洗脱、显色处理,用分光光度计检测洗脱液的吸光度,实现电泳条带的定量分析,补充凝胶成像仪的半定量结果。
分光光度计欢迎咨询长春博盛智芯科技,0431-85916189

 高光谱/多光谱成像
高光谱/多光谱成像  光路调节相关
光路调节相关  光学频率梳相关
光学频率梳相关  荧光
荧光  光学组件
光学组件  激光器|光源
激光器|光源 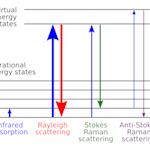 拉曼测量
拉曼测量  Libs激光诱导击穿
Libs激光诱导击穿  显微光谱测量
显微光谱测量  量子效率
量子效率